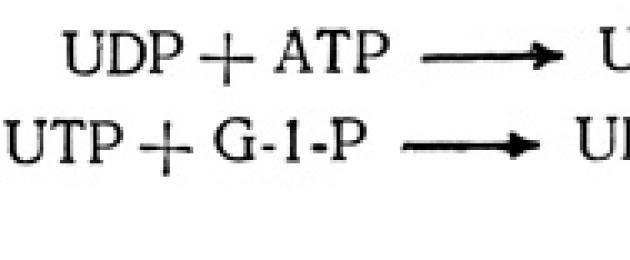В растениях в процессе фотосинтеза образуются не только фосфорные эфиры сахаров или простые сахара, но и более сложные формы углеводов - сахароза, крахмал, клетчатка. Распад сложных форм углеводов до простых протекает тоже очень быстро. Это наблюдается, например, при прорастании семян, старении вегетативных органов и др. Образующиеся при распаде простые сахара или их фосфорные эфиры оттекают в репродуктивные органы, где из них вновь синтезируются сложные углеводы. И, наконец, в растениях очень легко идут процессы взаимных превращений углеводов.
Взаимопревращение моносахаридов проходит через фосфорные эфиры сахаров или их уридиндифосфатпроизводные (УДФ-производные). УДФ-производные сахаров представляют собой тот или иной сахар, соединенный через два остатка фосфорной кислоты с уридином, например:
Рис.1. Уридиндифосфатглюкоза
Синтез сахарозы
Сахароза является наиболее важным из образующихся в растениях лигосахаридов, в форме которого связанный углерод и энергия транспортируются по всему растению. Она состоит из α-D-глюкозного остатка в его пиранозной форме, связанного гликозидной связью с β-D-фруктозой в фуранозной форме. Поскольку аномерный углеродный атом обоих моносахаридов участвует в образовании гликозидной связи, их полуацетальные группы заблокированы и ни одно из колец не может открыться. Таким образом, сахароза – это невосстанавливающий сахар (не восстанавливает реактивы Фелинга и Бенедикта), и за исключением ее чрезвычайной чувствительности к кислотному гидролизу, она химически инертна. При нагревании с кислотами, или под действием сахаразы (инвертазы) сахароза гидролизуется, образуя инвертный сахар – смесь глюкозы и фруктозы. Сахароза хорошо растворима в воде и обладает сладким вкусом.
Сахароза используется как продукт питания, а также в производстве
поверхностно-активных веществ (эфиры сахарозы с высшими кислотами). Основным
источником получения сахарозы является сахарная свекла, содержащая до 23 %
сахарозы, и сахарный тростник, стеб-ли которого содержат 10–18 % сахарозы. В
настоящее время установлено, что сахароза синтезируется не только в
хлоропластах, но и в цитоплазме фотосинтезирую-щих клеток из УДФ-глюкозы и
фруктозо-6-фосфата, возникшего из
дигидроксиацетонфосфата. Это вещество образуется при фотосинтезе в хлоропластах
и затем поступает в цитоплазму. В нефотосинтезирующих тканях (например, в
эндосперме прорастающих бобов клещевины) образование сахарозы из УДФ-глюкозы и
фруктозо-6-фосфата также происходит в цитоплазме клеток.
Сахароза (тростниковый, свекловичный сахар) – самый распространенный в природе дисахарид. В растениях он образуется из глюкозы и фруктозы. На первом этапе идет фосфорилирование глюкозы:
Глюкоза + АТФ → глюкоза-6-фосфат + АДФ,
затем глюкозо-6-фосфат изолируется в глюкозо-1-фосфат. Глюкозо-1-фосфат соединяется с УТФ, в результате чего отщепляется пирофосфатная кислота и образуется соединение глюкозы с уридиндифосфорной кислотой (УДФ) - уридиндифосфатглюкоза.
Одновременно идет фосфорилирование фруктозы под действием фермента фруктокиназы с участием АТФ:
фруктоза + АТФ → фруктозо-6-фосфат + АДФ.
После этого происходит взаимодействие УДФ-глюкозы с фруктозо-6-фосфатом с участием фермента сахарозофосфат-УДФ-глюкозилтрансферазы. Наконец, образовавшийся сахарозо-6-фосфат под действием фермента фосфатазы гидролизуется с образованием свободной сахарозы. Таким образом, для биосинтеза одной молекулы сахарозы необходимы 3 макроэргические фосфатные связи, эта реакция необратима. В нефотосинтезирующих тканях некоторых растений, например, в корнеплодах сахарной свеклы, клубнях картофеля и других сахароза может образоваться из свободной фруктозы:
УДФ-глюкоза + фруктоза ↔ сахароза + УДФ.
Реакция катализируется ферментом сахарозо-УДФ-глюкозилтрансферазой и в зависимости от условий может быть направлена как в сторону синтеза, так и в сторону расщепления сахарозы.
Синтез крахмала
Крахмал – запасной полисахарид растений, причем он может храниться в растении долго, или расходоваться достаточно быстро. На длительное время он запасается во многих семенах, клубнях и корневищах и используется только тогда, когда эти органы прорастают. На короткое время крахмал образуется в хлоропластах в период быстрого фотосинтеза, а в последующий темновой период он расходуется и оттекает из листьев в форме сахарозы. Крахмал всегда образуется и запасается в виде крахмальных зерен, находящихся в пластидах – хлоропластах либо амилопластах. Крахмальные зерна – это высокоорганизованные структуры, форма и размер которых очень разнообразны, но часто характерны для данного вида растения. Форма зерен может быть сферической, яйцевидной, чечевицеобразной или неправильной; размер может колебаться 1 до 100 мкм. Наиболее крупные крахмальные зерна у картофеля, а самые мелкие у риса и гречихи. Крахмальные зерна содержат до 20 % воды (из которых 10 % химически связано с крахмалом) и ряда концентрических слоев крахмала. Крахмальные зерна образуются путем наслаивания вновь образованных слоев на ранее существующие.
Содержание минеральных веществ в крахмале очень невелико – 0,2–0,7 %, они представлены в основном фосфорной кислотой. В крахмале найдены некоторые высокомолекулярные жирные кислоты (пальмитиновая, стеариновая и др.), содержание которых достигает 0,6 %. Крахмал представляет собой смесь двух полисахаридов – амилозы и амилопектина. Молекулы амилозы – это длинные неразветвленные цепи, содержащие от 100 до нескольких тысяч глюкопиранозных остатков, соединенных гликозидными связями. Изучение дифракции рентгеновских лучей показало, что молекулы амилозы имеют спиралевидную структуру диаметром 1,3 нм с шестью последовательными глюкозными остатками на один оборот спирали.
Молекулы амилозы растворимы в горячей воде, но образующийся раствор нестоек и затем происходит спонтанное осаждение амилозы, известное как ретроградация. Это происходит вследствие тенденции длинных и тонких амилозных молекул выстраиваться в линию рядом друг с другом и образовывать нерастворимые агрегаты с помощью водородных связей. Донором глюкозных остатков при биосинтезе амилозы может служить уридиндифосфатглюкоза-(УДФК). Для ее образования в реакционной среде необходимо наличие затравки, в качестве которой могут служить полисахариды, построенные всего лишь из 3-4 остатков глюкозы, соединенных α(1-4)-связями.
Остатки глюкозы переносятся на акцептор (затравку), где и происходит удлинение цепи. Реакция идет по схеме:
УДФГ + акцептор (Г)к -- УДФ + акцептор (Г)к + 1,
где Г - остатки глюкозы.
Фермент, катализирующий эту реакцию, называется УДФГ-крахмалглюкозилтрансферазой.
У большинства растений активным донором глюкозы является не УДФ-глюкоза, а аденозиндифосфатглкжозα(АДФГ). Реакция присоединения глюкозных остатков от АДФГ к низкомолекулярному акцептору идет аналогичным путем и катализируется ферментом АДФГ-крахмал-глюкозилтрансферазой. Синтез разветвленной молекулы амилопектина, имеющей α (1-6)-связи, происходит при помощи фермента α-глюкантрансферазы (Q-фермент). В синтезе крахмала участвуют и Д-фермент или глюкозилтрансфераза, образующий α(1-4)-связи и участвующий в образовании затравки.
Распад крахмала происходит при участии двух процессов - гидролиза и фосфоролиза.Гидролитический распад крахмала осуществляется под действием четырех ферментов класса гидролиз α-амилаза, катализирует расщепление α(1-4)-связи, причем связи разрываются беспорядочно. Конечный продукт такого распада - мальтоза, глюкоза, декстрины. Под действием β-амилазы происходит расщепление α (1-4)-связей с образованием остатков мальтозы. Фермент глюкоамилазы катализирует последовательное отщепление остатков глюкозы от молекулы крахмала. Амилопектин-1,6-глюкозидаза или R-фермент катализирует расщепление α(1-6)-связей в молекуле амилопектина, т. е. действует на точки ветвления.
Фосфоролиз - это присоединение фосфорной кислоты по месту разрыва глюкозидной связи между остатками моносахаридов в цепи полисахарида, при этом происходит образование глюкозо-1-фосфата. Эта реакция катализируется ферментомаглюконфосфорилазой, относящимся к классу трансфераз. Крахмал в растении может подвергаться очень быстрому распаду, так как ферменты распада находятся во всех органах растения.
Синтез целлюлозы
Целлюлоза не растворима в воде, она лишь набухает в ней. При кислотном гидролизе (кипячение в серной кислоте) превращается в глюкозу, при более слабом – в целлобиозу. С помощью рентгеноструктурного анализа установлено, что молекула целлюлозы имеет нитевидную форму. Эти нитевидные молекулы, благодаря водородным связям, соединяются пучками по 40–60 штук в мицеллу. В клеточных стенках растений мицеллы целлюлозы связаны во-дородными связями с различными гетерополисахаридами. Например, у белого клена ими являются соединенные между собой гликозидными связями ксилоглюкан, арабиногалактан, рамногалактурон. Кроме того, имеются данные о том, что в построении клеточной стенки растений принимает участие особый, богатый оксипролином гликопротеид экстензин.
Целлюлоза построена из остатков β-глюкозы. В биосинтезе целлюлозы принимает участие не свободная глюкоза, а ее ГДФ-производное - гуанозиндифосфатглюкоза при участии фермента целлюлозосинтетазы по схеме:
ГДФ - глюкоза + (глюкоза) к→ ГДФ + (глюкоза) к + 1
Распад целлюлозы идет преимущественно гидролитическим путем под действием фермента целлюлазы до дисахарида целлобиозы.
Транспорт углеводов осуществляется в виде сахарозы. В процессе фотосинтеза образуется много углеводов, и в этой связи большое значение имеет отток ассимилятов в другие части клетки из хлоропластов. Проникновение через мембрану хлоропластов фосфорилированных гексоз и сахарозы затруднено, наиболее легко через мембраны хлоропластов проникают триозофосфаты (ФГА и ФДА). Предполагается, что образующиеся сложные углеводы распадаются на триозофосфаты и в таком виде передвигаются в цитоплазму, где могут служить материалом для ресинтеза гексоз, сахарозы, крахмала.
Межклеточный паренхимный транспорт осуществляется двумя путями - по плазмодесмам (симпласту) или по свободному пространству (аппопласту). Сахароза, образовавшаяся в клетках мезофилла листа, десорбируется в аппопласт. Выходя из паренхимных клеток в аппопласт, сахароза расщепляется инвертазой на гексозы. Гексозы передвигаются по аппопласту к передаточным клеткам проводящих пучков по градиенту концентраций. При соприкосновении с передаточными клетками флоэмы они снова превращаются в сахарозу. Далее происходит загрузка ситовидных трубок, сахароза поступает против градиента концентраций, и требуется расход энергии (АТФ).
Предполагается, что сахароза преодолевает мембрану с помощью переносчика в комплексе с протоном. При этом благодаря работе Н + -АТФ-азы ионы Н + выкачиваются из клеток флоэмы, а затем поступают обратно по градиенту рН, увлекая за собой сахарозу против градиента ее концентрации. Основной транспортной формой углеводов по флоэме служит сахароза (С 12 Н 22 О 11). У некоторых видов наряду с сахарозой транспортной формой углеводов служат олигосахара (рафиноза, стахиоза), а также некоторые спирты.
Гемицеллюлозы, состоящие в основой из безводных остатков D-ксилозы, широко распространены в растительном царстве как компоненты клетки. Часто их рассматривают в качестве веществ, цементирующих ткани растения. Были исследованы гемицеллюлозы, выделенные из соломы, листьев, отрубей, эндосперма и зародыша пшеницы Triticum vulgare.
Синтез целлюлозы и пентозанов в растении недостаточно изучен. Гипотеза о том, что пентозаны образуются непосредственно из гексоз в результате окислительного декарбоксилирования, получила поддержку в работах Кострубина, который показал, что содержание свободных фруктозы и фруктозанов в стебле пшеницы уменьшается по мере усиления процессов лигнификации и возрастания количества гемицеллюлозы. Путем подкормки растущих растений пшеницы простыми сахарами, меченными С14, Нейш установил, что предшественником как целлюлозы, так и ксилозы является глюкоза. Распределение С14 указывает, что главным путем синтеза ксилана является отщепление углерода от глюкозы в положении 6 и что пентозы превращаются в ксилан только при образовании в качестве промежуточного соединения глюкозы.
Внешний вид выделенных гемицеллюлоз зависит в основном от метода извлечения. При наличии заметных количеств воды и высушивании образца на воздухе полученный продукт обычно представляет твердую, роговидную массу янтарного цвета, с трудом поддающуюся диспергированию или растворению. В том случае, когда образец высушивался с помощью растворителей с постепенно уменьшающейся полярностью, как правило, получали порошки белого цвета. При лиофильном высушивании очень разбавленных водных дисперсий гемицеллюлозы выделяли продукты с наименьшей плотностью и наибольшей растворимостью.
При гидролизе гемицеллюлозы и пентозаны дают производные пентоз и гексоз. Мономерными единицами, чаще всего встречающимися в пентозанах и гемицеллюлозах злаков, являются пентозосахара D-ксилоза и L-арабиноза. Кроме того, имеются данные о наличии некоторых гексозо-сахаров и их производных. К ним относятся D-галактоза, D-глкжоза, D-глюкуроновая кислота и 4-О-метил-1)-глюкуроновая кислота. В общем гемицеллюлозы и пентозаны, выделяемые из хлебных злаков и трав, характеризуются присутствием остатков L-арабофуранозы, соединенных в виде боковой цепи из единственного остатка с основной цепью из D-ксилопиранозных остатков. Обычно боковые цепи присоединяются в положении третьего остатка D-ксилозы, однако в некоторых случаях остатки D-глюкуроновой кислоты или 4-О-метил-глюкуроновой кислоты могут присоединяться в положении 2 или 3.
В своем обзоре, посвященном растительным гумми, Херст установил, что большинство этих гумми и растительных слизей обладает сильно разветвленной структурой, при которой гидроксильные группы расположены идеально для связывания молекул воды. Вследствие этого даже в наиболее концентрированных растворах гумми остаются сильно гидра — тированными. Тем не менее должны существовать межмолекулярные водородные связи между самими молекулами гумми, которые в сильно разбавленных растворах не проявляются достаточно сильно, но с удалением воды обнаруживают тенденцию к образованию структуры возрастающей жесткости. Возможно, что характерные физические свойства гумми и растительных слизей объясняются каким-то тонким взаимодействием между этими противоположными реакциями.
При получении и выделении углеводов из растительных тканей ферменты могут осуществлять их случайное расщепление или вызывать модификацию. Опыты на непроросших пшенице и ячмене показали, что встречающиеся в естественных условиях ферменты могут разрушать межмолекулярные связи молекулы пентозана, что приводит к быстрому снижению вязкости, сопровождающемуся медленным образованием свободных восстанавливающих групп. Это действие ферментов усиливается при прорастании зерна. Изменение соотношения между ксиланом и арабаном в пентозане изменяет его растворимость и может вызвать также растворение первоначально не растворяющихся в воде гемицеллюлоз. Хотя атакуемость пентозанов пентозаназами часто облегчает выделение некоторых компонентов клеточных стенок, а также клейковины и крахмала, остается непреложным фактом необходимость соблюдения определенных предосторожностей, чтобы в процессе получения гемицеллюлоз и пентозанов избежать их ферментативного расщепления.
В цикле Кальвина - Бенсона образуется, как уже отмечалось выше, фруктозо-6-фосфат (F-6-P). Этот гексозофосфат может под действием специфических ферментов превращаться в другие фосфорилированные гексозы, а именно в глюкозо-6-фосфат (G-6-P) и глюкозо-1-фосфат (G-1-P). Легко происходит и обратное превращение.
Из этих трех гексозофосфатов строятся затем цепи углеводных молекул, используемых для транспорта, хранения и в реакциях синтеза. Чтобы такие превращения могли произойти, гексозофосфаты предварительно должны быть активированы. Это обычно достигается в результате их присоединения к нуклеотидам - сложным кольцевым структурам, сходным с адениловой кислотой АТР. Продуктом такой реакции присоединения оказываются нуклеотидные производные моносахаридов, или нуклеотидсахара. Чаще других встречаются уридиндифосфоглюкоза (UDPG), образующаяся в реакции между уридинтрифосфатом (UTP) и глюкозо-1-фосфатом (G-1-P). Сам UTP образуется непрямым путем, в результате переноса фосфатной группы от АТР к UDP (уридиндифосфату).

Нуклеотиды АТР и UTP присутствуют во всех клетках, потому что они используются наряду с другими нуклеотидами в синтезе ДНК и РНК.
Сахара транспортируются по растению в виде сахарозы - дисахарида, состоящего из остатков глюкозы и фруктозы (рис. 5.2). Сахароза образуется в реакции между UDPG и F-6-P:


Равновесие этой реакции сильно сдвинуто в сторону синтеза сахарозы, чем обеспечивается возможность накопления данного дисахарида в значительных концентрациях. Для последующего использования сахароза должна предварительно подвергнуться расщеплению: фермент инвертаза катализирует ее гидролиз с образованием свободной глюкозы и фруктозы.

Энергия гликозидной связи в такой реакции растрачивается впустую, распределяясь между двумя молекулами. Поэтому если глюкозе и фруктозе предстоит распад в процессе дыхания или участие (в качестве сырья) в синтезе полисахаридов, то они должны предварительно вновь подвергнуться фосфорилирова- нию за счет АТР. Процессы синтеза и распада сахарозы наглядно показывают, что часто анаболические и катаболические реакции (реакции синтеза и распада) идут по разным путям.
Синтез крахмала и целлюлозы
Длинные полимерные цепи крахмала и целлюлозы построены из одних и тех же элементарных звеньев - остатков глюкозы, только соединенных по-разному. Это структурное различие обусловливает то, что два рассматриваемых полимера глюкозы (глюканы) существенно различаются по своей природе; крахмал, например, легко переваривается в организме человека" а целлюлоза совсем не переваривается. Главное же их различие состоит в том, что 1-й и 4-й углеродные атомы двух соседних остатков глюкозы соединены у крахмала α-связями, а у целлюлозы (β-связями (рис. 5.3). Крахмал представлен двумя формами: линейным полимером, или амилозой, не содержащим никаких других связей, кроме α-1,4-гликозидных, и разветвленным полимером, или амилопектином, в котором наряду с α-1,4-гликозидными связями имеются и 1,6-связи. Различие в характере связей определяет и неодинаковое пространственное расположение полимерных цепей. Крахмал - главный запасной полисахарид растения. Он нерастворим в воде и отлагается слой за слоем в крахмальных зернах, содержащихся в хлоропластах (см. рис. 2.20) или в лишенных хлорофилла лейкопластах запасающих тканей стебля, корней и семян. Иногда клетки запасающей ткани оказываются буквально забиты крахмальными зернами, которые легко в них выявить, поскольку они способны окрашиваться иодом в синий цвет. Будучи нерастворим в воде, крахмал в отличие от сахарозы и от гексоз не вызывает в клетках осмотического эффекта (см. гл. 6). Поэтому образование крахмала в клетках листа в периоды интенсивного фотосинтеза предотвращает подавление последнего, происходящее в результате накопления продуктов фотосинтеза. В темноте крахмал постепенно снова гидролизуется с образованием глюкозофосфата, который затем превращается в сахарозу, транспортируемую в другие части растения.

Рис. 5.3. Структура крахмала (А) и целлюлозы (Б) (С изменениями по J. Bonner, A. W. Galston. 1952. Principles of Plant Physiology, San Francisco, W. H. Freeman and Co.) Обратите внимание, что химические формулы крахмала и целлюлозы одинаковы, различаются же эти полисахариды пространственной ориентацией их кислородных мостиков. А. Крахмал, главный запасной полисахарид растения, построен из двух хорошо различимых компонентов: амилозы с ее длинными неразветвленными цепями из глюкозных звеньев и амилопектина, состоящего из большого числа коротких разветвленных цепей. Б. Целлюлоза, главный компонент первичной клеточной стенки, существует в виде длинных полимерных цепей. Цепи объединяются в мицеллярные тяжи, а последние - в микрофибриллы. Микрофибриллы, достаточно крупные для того, чтобы их можно было рассмотреть при помощи электронного микроскопа, составляют "основу" и "уток" клеточной стенки
Исходным продуктом для синтеза крахмала служит аденозиндифосфоглюкоза (ADPG), образующаяся из АТР и G-1-P:

Молекула крахмала строится путем постепенного добавления одного глюкозного остатка за другим в реакции ADPG с предобразованной глюкозной цепью:
При низком содержании сахарозы крахмал расщепляется и. переводится в сахарозу. Однако сначала он расщепляется до остатков глюкозы и к каждому из них присоединяется остаток фосфорной кислоты, т. е. образуется G-1-P, чем обеспечивается сохранение энергии связи:
Этот G-1-P может затем использоваться для синтеза сахарозы, который мы описали выше. В семенах и в некоторых других органах, в которых одновременно идет расщепление больших количеств крахмала, он распадается до дисахарида мальтозы (G-G) под действием аα-амилазы. Мальтоза затем распадается до глюкозы, из которой (для транспорта) вновь синтезируется сахароза. На этом втором пути в отличие от первого энергия связи не сохраняется, поэтому здесь для превращения глюкозы в глюкозо-6-P требуется АТР.

Целлюлоза, самый распространенный на Земле углевод, служит главным компонентом первичной клеточной стенки. Молекулы ее строятся подобно тому, как строятся молекулы крахмала, с тем, оцнако, отличием, что роль донора глюкозы играет другое нуклеотидное производное моносахарида - гуанозин- дифосфоглюкоза (GDPG) - и что связь между мономерными.звеньями принадлежит не к α-, а к β-типу.

В некоторых случаях донором глюкозы для синтеза целлюлозы может быть и UDPG.
В организме высших растений целлюлоза расщепляется редко (если не считать распада, обусловленного деятельностью микробов). Два известных исключения из этого правила касаются клеток в отделительной зоне листа, образующейся перед сбрасыванием листьев, и сосудов ксилемы, у которых поперечные стенки растворяются. В отделительной зоне листа фермент целлюлаза разрушает клеточные стенки, расщепляя содержащуюся в них целлюлозу до отдельных мономерных единиц, т. е. до глюкозы. Клеточные стенки, ослабленные этим процессом, в конце концов разрываются, и лист сбрасывается.
Целлюлозные микрофибриллы в клеточной стенке скреплены при помощи матрикса из смешанных полисахаридных цепей, главным образом ксилоглюканов и арабиногалактанов (см. рис. 2.31). (Ксилоза и арабиноза - пятиуглеродные сахара (пентозы), а галактоза - гексоза, родственная глюкозе.) Эти полисахариды синтезируются также из предшественников, нуклео- тидсахаров, преимущественно в диктиосомах. Отшнуровывающиеся от диктиосом пузырьки в конце концов сливаются с плазмалеммой и таким путем передают свое содержимое формирующейся клеточной стенке.
Итак, все полисахариды легко переходят один в другой, но синтез их всегда идет через стадию нуклеотидсахаров, тогда как распад совершается более прямым путем.
Процессы образования микрофибрилл целлюлозы (и вообще биосинтеза целлюлозы) могут протекать внутри или вне клеток. Внутриклеточные процессы являются в полной мере биохимическими и включают серию сложных превращений, в результате которых продукты жизнедеятельности клеток (растений, животных, микроорганизмов) превращаются в активированную форму глюкозы, после чего глюкоза может войти в состав инертной, нерастворимой, устойчивой микрофибриллы. Насколько известно, все эти процессы происходят внутри клетки пли в мембране ее цитоплазмы; они подробно описаны в предыдущем разделе. Однако имеются данные, показывающие, что в действительности включение остатков глюкозы в микрофибриллу происходит вне мембраны цитоплазмы. Следовательно, эти процессы, как биохимические, так и физические, протекают вне клетки и ниже будут рассмотрены только такие процессы.[ ...]
Полученные им данные подтверждают, что в результате жизнедеятельности клеток A. xylinum происходит превращение экзогенного субстрата в целлюлозу и двуокись углерода, причем исходным веществом для синтеза целлюлозы, вероятно, является фосфат гексозы. Глязер впервые осуществил биосинтез целлюлозы в бесклеточной системе из A. xylinum. Нерастворимый фермент, осажденный центрифугированием (lOOOOOg), катализировал перенос остатков D-глюкозы от УДФ-D-глюкозы, меченной изотопом 14С. В результате образовывался радиоактивный полисахарид, нерастворимый в воде и щелочи. Методом ферментативного гидролиза в присутствии целлюлазы Myrotheciurn verrucaria, а также методом частичного кислотного гидролиза и выделения целлобиозы, обладавшей постоянной радиоактивностью, было установлено, что синтезированный полисахарид является целлюлозой. Образованию нерастворимой целлюлозы способствовало добавление высокомолекулярных, растворимых целлодекстринов. Ферменты, ответственные за синтез целлюлозы, были отделены от ферментов, катализирующих образование УДФ-Б-глюкозы из a-D-глюкозо-1 -фосфата. Однако содержание в целлюлозе радиоактивной глюкозы составляло только 1-2% того количества, которое содержится в образующейся целлюлозе, когда субстратом является УДФ-0-глюкоза-14С. При использовании УДФ--глюкозы-иС в целлюлозе содержалось приблизительно такое же количество радиоактивной глюкозы, как и в целлюлозе, синтезировапиой Глязером. Барбер также установил, что донором D-глюкозы-НС при биосинтезе целлюлозы может служить и ТДФ-0-глюкоза-14С, но она менее активна, чем УДФ-0-глкжоза-14С. Целлюлоза не образовалась, когда в качестве субстрата применили другие нуклеотиды.[ ...]
Перенос Б-глюкозного остатка от нуклеозиддифосфат-О-глюкозы на глюколииид происходит вблизи мембраны или па мембране цитоплазмы, затем О-глюкоза, соединенная с липидным компонентом, мигрирует за пределы клетки. В этом процессе липидный компонент осуществляет транспортную функцию, делая возможным проникновение глюкозы из клетки во внешнюю сферу, где глюкоза иолимеризуется с образованием целлюлозы.[ ...]
Изучение процессов включения в состав полисахаридов и последующего выделения из них радиоактивной глюкозы или сахарозы, протекающих в тканях корней пшеницы, также подтвердило обратимость биосинтеза целлюлозы и присутствие в клетках корней активной целлюлазы (или целлюлаз), вызывающей деструкцию микрофибрилл после их образования. Эти данные опровергают ранее установившийся взгляд на целлюлозу, как на вещество инертное в процессах метаболизма. Полученные этими исследователями данные не позволяют, однако, сделать каких-либо других выводов, поскольку «не имеется достаточного количества сведений для объяснения механизма обмена».[ ...]
Другой фермент , способный образовывать на субстрате ГДФ-0-глюкозы-14С полисахарид, по свойствам идентичный природной целлюлозе, обнаружен в быстро растущих корневых тканях маша, гороха, пшеницы, во фруктовой мезге, а также семенах и волокнах незрелых хлопковых коробочек . Роль фермента, синтезирующего целлюлозу, заключается в переносе активированных D-глю-козных остатков на растущую полисахаридную цепь. Этот фермент был очень специфичен в случае ГДФ-Г)-глюкозы, но не проявлял специфичности при использовании других меченных изотопом 14С нуклеотидов глюкозы, у которых агликонами были урацил, аденин, тимин или цитозин, и такие нуклеотиды не могли служить субстратами при биосинтезе целлюлозы.
Статья на конкурс «био/мол/текст»: Целлюлоза широко распространена в живой природе: ее молекулы являются самым распространенным биополимером на нашей планете. Это вещество - основной компонент растительных волокон, имеющее огромное значение как для глобальной экосистемы Земли, так и для различных областей промышленного производства. Растительные клетки долго хранили секрет биосинтеза этого полимера, но методы молекулярной генетики и биоинформатики позволили пролить свет на процессы его формирования. Статья посвящена истории открытия и исследования биосинтеза целлюлозы, а также последним результатам моделирования молекулярных комплексов растений, ответственных за биосинтез целлюлозного полимера.
Растительные волокна очень давно и прочно вошли в нашу повседневную жизнь. Мы встречаемся с ними, когда читаем газету, надеваем джинсы или садимся за свой рабочий стол. Столь разнообразные по свойствам материалы как хлопковая ткань, бумага или древесина весьма схожи по химической структуре и представляют собой растительные волокна или целлюлозу .
Исследования археологов показывают, что люди используют их со времен палеолита, а это значит, что уже более 30 тыс. лет целлюлоза была материальным носителем нашей культуры. Изобретение и широкое распространение книгопечатания дало сильный толчок в развитии человеческой цивилизации, который не обошелся без целлюлозы. Возможно, когда-нибудь мы полностью перейдем на электронные книги и журналы, но пока этого не произошло, а школьники и студенты хоть иногда пользуются бумажными учебниками и тетрадками, целлюлоза по-прежнему является важным и необходимым участником процесса накопления и передачи знаний. Но кто же те трудолюбивые «ткачихи», которые все это время изготавливали для нас растительные волокна? Что собой представляют и как работают растительные фабрики, производящие столь качественную продукцию в огромных количествах? Ответить на эти вопросы оказалось непросто.
Впервые в поле зрения ученых целлюлоза попала во второй половине 17 века, когда Роберт Гук сфокусировал свой микроскоп на препарате среза пробкового дерева (рис. 1). Тогда английский исследователь увидел сетчатую структуру среза, отдельные ячейки которой он и назвал клетками (от лат. cellula; еще не целлюлоза, но уже близко даже по звучанию слов). Сейчас мы знаем, что Гук наблюдал не сами клетки, а только перегородки между ними или, как говорят ученые, клеточные стенки .
Намного позднее, в первой половине 19 века, французский химик Ансельм Пайя анализировал химический состав перегородок, которые почти двести лет тому зарисовал Гук. Он установил, что основную их часть составляет волокнистое вещество, которое Ансельм Пайя назвал целлюлозой . Изучение структуры этого вещества показало, что оно представляет собой длинные ниточки или, точнее сказать, цепочки, состоящие из одинаковых повторяющихся звеньев, которыми являются более мелкие молекулы глюкозы. По мере накопления научных фактов, ученые обнаружили интересную закономерность, касающуюся целлюлозы. Растения способны синтезировать целлюлозу и откладывать ее в составе оболочек собственных клеток, а животные же никогда (если быть совсем точным, то за очень редким исключением) не образуют этот полимер. Целлюлоза оказалась таким веществом, которое кардинальным образом отличает растения от животных.
По мере развития биологии ученых уже интересовали не только вопросы описания живых организмов, их формы, окраски, но и то, как они функционируют, почему имеют ту или иную окраску, какими процессами это обеспечивается и как они протекают в клетках живых организмов. К середине 20-го века ученым стало ясно, что если в растениях или животных присутствует какое-либо вещество, то, значит, есть биохимическая реакция, в которой это вещество синтезируется, и фермент, обеспечивающий эту реакцию. Исследователи приступили к изучению метаболизма живых организмов.
В изучении метаболизма целлюлозы ничего не предвещало серьезных трудностей. Этот полимер устроен достаточно просто, поэтому предполагалось, что и процессы, обеспечивающие его накопление, не очень сложны. Целлюлозу рассматривали как элемент клеточной стенки растений, а саму клеточную стенку представляли как «картонную коробку» для живого содержимого клетки. Образование целлюлозы учёные представляли как процесс постепенного утолщения стенок «коробки» (что-то подобное наслоению накипи на стенках чайника, если его долго не чистить). Однако в действительности все оказалось значительно сложнее. Многочисленные попытки изучить реакцию накопления целлюлозы и выделить растительный фермент не увенчались успехом. Все большее число экспериментальных данных указывало, что при биосинтезе целлюлозы задействован целый комплекс ферментов, составляющий сложную систему. Складывалась парадоксальная ситуация - для синтеза достаточно простого, с точки зрения биохимии, вещества в живой клетке задействованы очень сложные механизмы. Эти процессы оказались настолько сложны, что до сих пор ученые не могут воспроизвести в пробирке биосинтез целлюлозы у растений, хотя многое здесь уже понятно благодаря бактериям, а также методам генетики и биоинформатики.
Как это часто бывало в науке 20 века, бактерии оказывали помощь в изучении сложных биологических процессов. Клетки этих мельчайших живых организмов устроены проще, поэтому и изучать их легче. В случае с целлюлозой микробы также сыграли немаловажную роль. Следует отметить, что в целом для бактерий не свойственно образование целлюлозы, однако некоторые виды, среди которых (рис. 2, видео), способны синтезировать это вещество .
Рисунок 2. Бактерии : колонии, образующиеся в лабораторных условиях при росте на плотных питательных средах (а ) и сложное микробное сообщество, на кухне чаще называемое чайным грибом (б ).
Видео. Биосинтез целлюлозы бактериями (видеомикроскопия в режиме реального времени)
Для клеток бактерий удалось сделать то, что не удавалось сделать для растительных клеток, а именно: выделить фермент, который синтезирует целлюлозу. Проанализировав бактериальную целлюлозосинтазу (именно так называется фермент, который синтезирует целлюлозу), ученые установили ключевой участок молекулы фермента, где происходит «нанизывание» отдельных звеньев глюкозы в длинную цепочку целлюлозы . Эта информация была очень ценной для исследователей, поскольку позволяла по аналогии с бактериальными ферментами искать похожие ферменты растений. К тому же ученые очень хорошо знали, что подавляющее число ферментов (в том числе и целлюлозосинтаза) относится к белкам, а информация о структуре всех белков записана в генах посредством генетического кода. Другими словами, можно перевести «текст» генетического кода на язык белковых ферментов, а где начинается работа с генетическими последовательностями, там генетики могут подключиться к исследованию и предложить свою помощь.
Если невозможно выделить и изучать ферменты биосинтеза целлюлозы, то можно выделить и изучать гены, которые кодируют эти ферменты. Ведь с генами работать намного проще, чем с ферментами. А если ферменты, которые изучаются, имеют особенности в своей структуре, то информация об этих особенностях записана и в соответствующих генах. Поэтому можно сравнивать не только сами ферменты и искать в них интересующие участки, но и гены, которые их кодируют. Ученые использовали информацию о структуре бактериальных генов целлюлозосинтаз для поиска их растительных аналогов. Подход генетиков принес долгожданный успех в расшифровке секретов биосинтеза целлюлозы растениями. В 1996 году группе ученых во главе с Дж. Пеар удалось идентифицировать два гена целлюлозосинтаз хлопчатника и один ген риса . Это были первые открытые растительные гены, кодирующие эти ферменты. Располагая данными о структуре растительных генов, ученые смогли перевести генетическую информацию на язык белковой последовательности фермента. В свою очередь, анализ белковых последовательностей при помощи биоинформатических алгоритмов позволил смоделировать структуру растительных целлюлозосинтаз (рис. 3).

Рисунок 3. Структура целлюлозосинтазы хлопчатника. а - схема вторичной структуры: шесть β-слоев обозначены стрелками, а тринадцать α-спиралей бочонками. б - пространственная структура молекулы: подписаны α-спирали и β-слои с числом, обозначающим их последовательность в аминокислотной цепочке белка (в направлении от N - к С -концу). α-Спирали, выделенные серым цветом , и β-слои, отмеченные желтым , входят в состав каталитического центра фермента.
Оказалось, что для появления способности к синтезу целлюлозы, шесть растительных ферментов должны объединиться вместе, а такой шестикратный комплекс, в свою очередь, должен объединиться с шестью подобными ему шестикратными комплексами. Растительная целлюлозосинтаза оказалась очень «компанейским» ферментом, который работает только в команде, составляющей в конечном итоге 36 отдельных ферментов (рис. 4).

Рисунок 4. Строение целлюлозосинтазного комплекса. а - модель структуры комплекса. Шесть отдельных ферментов образуют шестикратные комплексы, которые, в свою очередь, формируют целлюлозосинтезирующий комплекс. Каждый фермент синтезирует одну цепочку целлюлозы, которые, соединяясь вместе, формируют целлюлозную микрофибриллу. б - микрофотография внутренней поверхности оболочки растительной клетки табака, полученной с помощью трансмиссионной электронной микроскопии. Целлюлозосинтезирующий комплекс (в окружности) связан с микрофибриллой целлюлозы (отмечена стрелкой ). Риска: 200 нм.
Объединившись особым образом, эти тридцать шесть ферментов включаются в биологическую мембрану и только тогда начинают нанизывать отдельные звенья глюкозы в длинную цепочку целлюлозного полимера. Растительная целлюлозосинтаза - это тридцать шесть «ткачих», которые по шесть рассажены в шесть отдельных команд. Каждая ткачиха ткет свою нить - отдельную цепочку целлюлозы, - которая сплетается вместе с другими и дает упругую косичку из 36 отдельных ниточек. Такая косичка называется целлюлозной микрофибриллой . Все ткачихи должны работать слаженно, чтобы косичка получилась равномерной и без перекосов. Если каждая ниточка микрофибриллы на месте и косичка сплетена ровно, без брака, то ученые говорят о кристаллической форме целлюлозы, а если косичка где-то расплелась, растрепалась, - то это аморфная целлюлоза (рис. 5).

Рисунок 5. Структурная модель микрофибриллы целлюлозы. а - Микрофибрилла целлюлозы, состоящая из 36 целлюлозных цепочек. б - Несколько цепочек целлюлозы, образующие кристаллическую область. в - Цепочка молекулы целлюлозы, состоящая из «звеньев» глюкозы.
Хорошо сплетенная целлюлозная микрофибрилла - отличная опора для всего растения, а среди них встречаются настоящие гиганты. Хорошо уложенные «косички» целлюлозы образуют прочный и длинный опорный скелет, который надежно удерживает и многовековой дуб, и раскидистую иву. А ведь, по большому счету, эта прочность рождается благодаря стараниям тридцати шести искусных ткачих!
Исследования молекулярных комплексов, ответственных за биосинтез целлюлозы, важны и перспективны, поскольку имеют как фундаментальное, так и прикладное значение. С одной стороны, исследование биосинтеза целлюлозы позволяет нам познавать процессы роста и развития растительной клетки, понять механизмы обмена информацией между клетками и окружающей средой, другими словами - узнать больше о том динамическом равновесии, называемом жизнью. А с другой стороны, исследование биологических процессов, которые лежат в основе биосинтеза целлюлозы, открывает широкие перспективы влияния на формирование растительного волокна, замены и моделирования его свойств под запросы конкретной области производства.
Литература
- L. Sethaphong, C. H. Haigler, J. D. Kubicki, J. Zimmer, D. Bonetta, et. al.. (2013). Tertiary model of a plant cellulose synthase . . 93 , 12637-12642;
- Monika S. Doblin, Isaac Kurek, Deborah Jacob-Wilk, Deborah P. Delmer. (2002). Cellulose Biosynthesis in Plants: from Genes to Rosettes . Plant and Cell Physiology . 43 , 1407-1420;
- A. J. Bowling, R. M. Brown. (2008). The cytoplasmic domain of the cellulose-synthesizing complex in vascular plants . Protoplasma . 233 , 115-127;
- Cosgrove D.J. Cell Walls: Structure, Biogenesis, and Expansion . In: Plant Physiology (2nd Edition) / ed. by Taiz L. and Zeiger E. 2006. P. 313–338.